「ジェネリック医薬品」と
「バイオ後続品(バイオシミラー)」の活用
「ジェネリック医薬品」と
「バイオ後続品(バイオシミラー)」とは
新薬の特許が切れてから別の会社で発売される同じ成分の医薬品を後発薬といいます。後発薬には化学合成品の後発薬「ジェネリック医薬品」と生物の力を利用して作るバイオ医薬品の後発薬である「バイオ後続品(バイオシミラー)」の2種類があります。いずれも薬価(薬の価格)が安くなっています。

ジェネリック医薬品とは
今ではよく⽿にするようになった「ジェネリック医薬品」ですが、これは先発医薬品と同じ有効成分を同じ量含んでおり、先発医薬品と同様の効能や効果が得られると認められたお薬のことです。
ジェネリック医薬品の「ジェネリック(generic)」とは「⼀般的な」という意味です。⽇本より早くからジェネリック医薬品が普及している欧⽶では、処⽅せんに記載するお薬の名前を、商品名ではなく⼀般名(成分名)で記載することが多いため、「ジェネリック医薬品」と呼ばれています。新薬である先発医薬品と⽐べて、ジェネリック医薬品の薬価は、約5割になるように定められています。
ジェネリック医薬品はなぜ安いのでしょうか
⼀般的に新薬(先発医薬品)の研究開発には、10〜20年程度もの⻑い年⽉と多額の費⽤が必要であるといわれており、研究開発にかかったコストがお薬の価格に反映され、「薬価」として⽇本全国どこの医療機関でも同じ価格に定められています。
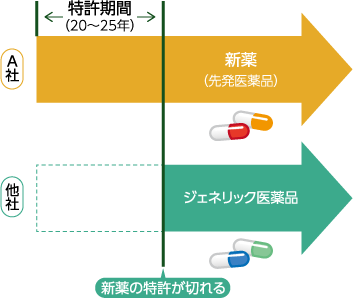
また、先発医薬品には独占的に販売できる期間が定められています。それが「特許期間」で、新薬の研究開発から20〜25年間は、他の医薬品メーカーはジェネリック医薬品を製造することはできません。
この特許期間が終わると、新薬の成分は国⺠共有の財産となるため、ようやく他の医薬品メーカーがジェネリック医薬品として製造・販売できるようになります。
ジェネリック医薬品を製造する際には、一般的に開発などに要する時間や費⽤が少なく、コストを抑えることができます。

※自己負担額が高くなりすぎないようにする仕組み(高額療養費制度)との関係で、ジェネリック医薬品を使っても、自己負担額が必ずしも下がらない場合もあります。
「有効性と安全性が同じ」と認められています
ジェネリック医薬品は先発医薬品と同じように、国で定められた法律*に基づいて厚⽣労働⼤⾂の承認を得ています。先発医薬品と⽐較して、「⾝体の中で同じように溶け出すか(溶出試験)」、「同じような速さで同じくらいの量の有効成分が吸収されているか(⽣物学的同等性試験)」さらに、製剤として「⻑期間安定に保存できるのか、温度や湿度の変化によって品質が変わらないか(製剤の安定性試験)」などを確認するための試験などが⾏われます。
これらの試験の結果、国で定められた基準をクリアしたものがジェネリック医薬品として承認されています。「有効性、安全性が先発医薬品と同じである」と認められたお薬ですから、先発医薬品と同じように使⽤することができます。
*医薬品、医療機器等の品質、有効性及び安全性の確保に関する法律(薬機法)


※自己負担額が高くなりすぎないようにする仕組み(高額療養費制度)との関係で、ジェネリック医薬品を使っても、自己負担額が必ずしも下がらない場合もあります。
参考:後発医薬品(ジェネリック医薬品)に関する基本的なこと~一般の皆様への広報資料~ リーフレット(青、A4三つ折り) 2022.3版 (厚生労働省)https://www.mhlw.go.jp/content/000922740.pdf(2025年6月参照)
監修者略歴
日本臨床腫瘍薬学会(JASPO)顧問
遠藤 一司(えんどう かずし)先生
- 【学歴・職歴等】
昭和48年明治薬科大学製薬学科卒業
厚生省(現厚生労働省)監視指導課薬事専門官、医療課医療指導監査官、
老人保健課課長補佐、北海道地方医務局薬事専門官
厚生労働省薬事・食品衛生審議会 臨時委員(医薬品安全対策調査会担当)
医薬品基金(現医薬品医療機器総合機構)調査役、企画課長
北海道がんセンター・国立がんセンター東病院薬剤部長
明治薬科大学医薬品安全管理学 教授
明治薬科大学 客員教授・評議員
日本病院薬剤師会 副会長・専務理事
日本臨床腫瘍薬学会 理事長
- 【現在】
日本臨床腫瘍薬学会(JASPO) 顧問
北海道薬剤師会 副会長
厚生労働省サリドマイド及びレナリドミドの安全管理に関する検討会 構成員
RevMate第三者評価委員会 委員
日本薬学図書館協議会 理事
日本薬剤師研修センター 特別顧問
日本病院薬剤師会 名誉会員



